Hémoglucotest et injection d’insuline
Traitement unique du diabète de type 1 et complémentaire dans le diabète de type 2, l’injection sous cutané d’insuline (hormone hypoglycémiante) permet la régulation de la glycémie. Elle prévient le développement des complications, sans pour autant guérir le diabète. Afin d’assurer l’équilibre glycémique, le contrôle du taux de sucre dans le sang doit être pluriquotidien. L’hémoglucotest permet cette mesure par la lecture instantanée de la glycémie vasculaire capillaire.
Les différents diabètes
Le diabète de type 1 (ou diabète insulinodépendant (DID)) : Représente environ 10% des diabétiques en France.
C’est une maladie auto immune, les anticorps et lymphocytes du patient détruisent les cellules béta du pancréas qui produisent l’insuline. Il en résulte une carence en insuline et donc un taux élevé de glucose dans le sang.
Il est habituellement découvert chez les personnes jeunes.
Le diabète de type 2 (ou diabète non insulinodépendant (DNID)) : Représente environ 90% des diabétiques en France.
C’est une maladie évolutive sans cause unique, elle est favorisée par une prédisposition génétique mais aussi le surpoids, l’obésité et la sédentarité. Cette anomalie métabolique résulte de 2 phénomènes :
– L’insulinorésistance : Diminution de la sensibilité à l’insuline qui induit une augmentation de sa sécrétion pour réguler la glycémie.
– L’insulinodéficience : L’épuisement des cellules béta entraine un déficit en insuline et donc une augmentation de la glycémie.
Le DNID est dépisté généralement chez les personnes de plus de 40ans, même si l’âge de début peut être plus précoce.
Le diagnostic du diabète se fait par la mesure de la glycémie à jeun. La valeur moyenne étant comprise entre 0.8g/l et 1.1g/l. Si la glycémie dépasse 1,26 g/l lors de deux dosages successifs, le diabète est déclaré. D’autres critères peuvent confirmer ou préciser le diagnostic.
Les hyperglycémies répétées et prolongées entraînent à long terme une altération des nerfs et des vaisseaux sanguins présents dans tout le corps. Ces complications peuvent se traduire par une cécité, une atteinte des pieds, conduisant parfois à l’amputation, des infarctus et des accidents vasculaires cérébraux, des troubles de l’érection ou une insuffisance rénale.
Le diabète est une maladie qui ne se guérit pas mais qui peut être équilibrée, par l’injection sous cutané d’insuline pour le diabète de type 1 et par le respect de règles hygiéno-diététiques, la prise d’antidiabétiques oraux, puis par l’injection d’insuline pour le type 2.
L’insulinothérapie peut également être prescrite, dans certains cas et de façon temporaire, aux femmes atteintes de diabète gestationnel.
L’origine de l’injection d’insuline
Le diabète a été mentionné pour la 1ère fois, en 4000 avant J.-C. en Chine sous le nom d’urine sucrée, et ses symptômes (soif intense et amaigrissement) ont été décrits en 1500 avant J.-C.
Il faudra pourtant attendre 1921 pour que le chercheur Canadien Frederick Grant Banting et son équipe découvrent l’insuline. L’année suivante aura lieu la 1ère injection d’insuline chez un jeune garçon de 14 ans atteint de diabète au stade de coma. Le Prix Nobel sera décerné à Frederick Grant Banting en 1923, pour sa production industrielle et sa commercialisation d’insuline à partir de pancréas de bœuf et de porc.
En 1955, les chercheurs comprennent qu’il y a une différence entre l’insuline humaine et animale. À la fin du 20ème siècle, l’insuline sera produite par génie génétique. Sa structure sera ensuite modifiée afin de changer le temps d’action.
À ce jour il existe différents types d’insulines que l’on distingue en fonction de leur durée et rapidité d’action :
– Les insulines rapides
– Les analogues rapides ou ultrarapides
– Les insulines retard
– Les analogues lents
– Les mélanges d’insulines
Les conditionnements gradués en unités d’insuline (100U pour 1ml) peuvent être en :
– Stylos jetables
– Cartouches (pour stylos rechargeables)
– Flacons
– Et les dispositifs d’injection à usage unique (seringues pour les flacons/aiguilles pour les stylos)
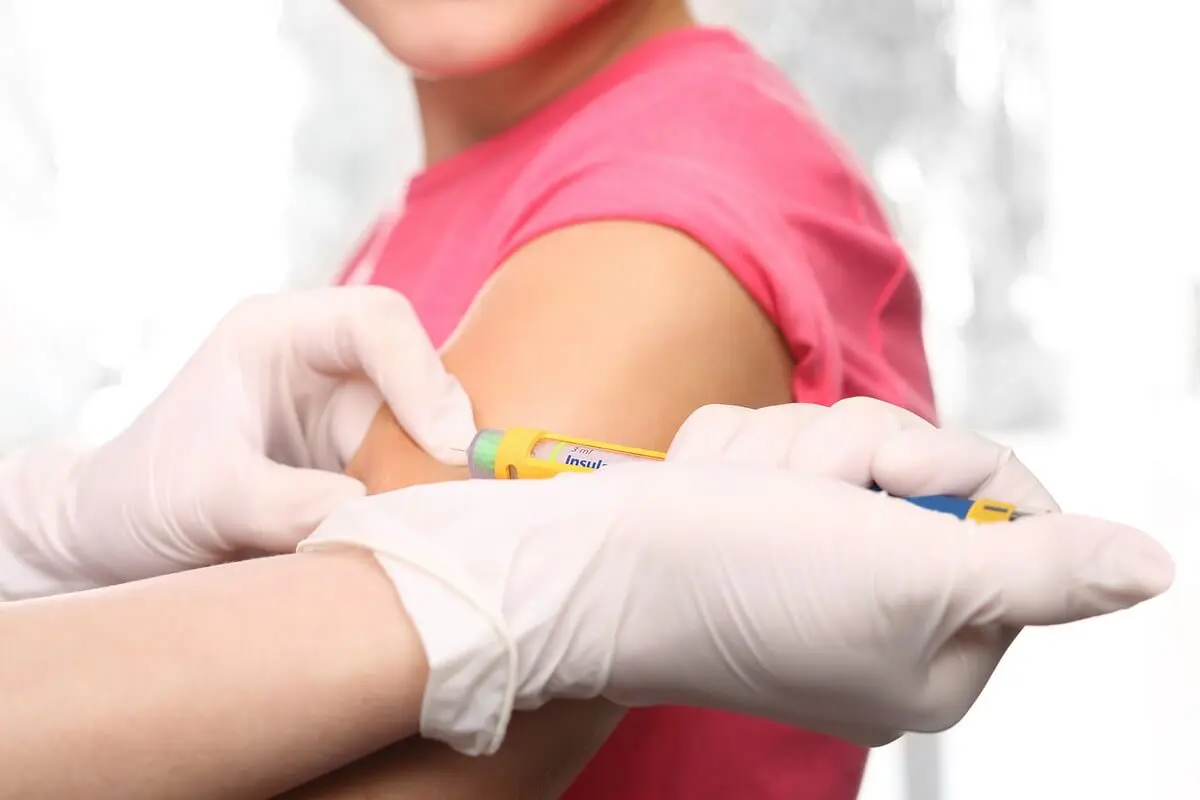
Qui peut pratiquer ces gestes ?
Toute injection d’insuline doit être précédée d’un dosage de la glycémie.
Dosage de la glycémie :
– La glycémie peut être surveillée dans un laboratoire d’analyse, par une prise de sang avec un dosage de la glycémie à jeun ou tous les 3 mois par un dosage de l’hémoglobine glyquée.
– L’hémoglucotest (HGT ou Dextro) permet le dosage de la glycémie capillaire grâce à une goutte de sang, avec une lecture immédiate du résultat. Le prélèvement de sang par ponction capillaire relève du rôle prescrit de l’infirmier (Art. R.4311-7 du CSP). Le recueil des données biologiques par des techniques à lecture instantanée est du rôle propre de l’infirmier (Art. 4311-5 du CSP). L’HGT est effectué par le soignant (infirmier, médecin ou sage-femme) dans la prise en soin d’un patient diabétique mais également lors d’un malaise, pour détecter une éventuelle hypoglycémie.
Injection d’insuline :
Ce geste fait partie du rôle prescrit de l’infirmier (Art. 4311-7 du CSP). Il peut être réalisé au sein d’un établissement de soin comme au domicile du patient. Il s’agit d’une injection sous cutané.
Il existe différentes longueurs d’aiguilles selon le patient et selon le site d’injection :
– Mini 5mm : Chez l’enfant ou chez l’adulte avec peu de tissus adipeux. Pas de nécessité de faire le pli cutané.
– Courte 8mm : Chez l’adulte. Nécessite un pli cutané afin d’’éviter une injection intra musculaire.
– Originale 12.7mm : Pour les fortes doses d’insuline mais non recommandée à cause du risque d’injection intra musculaire.
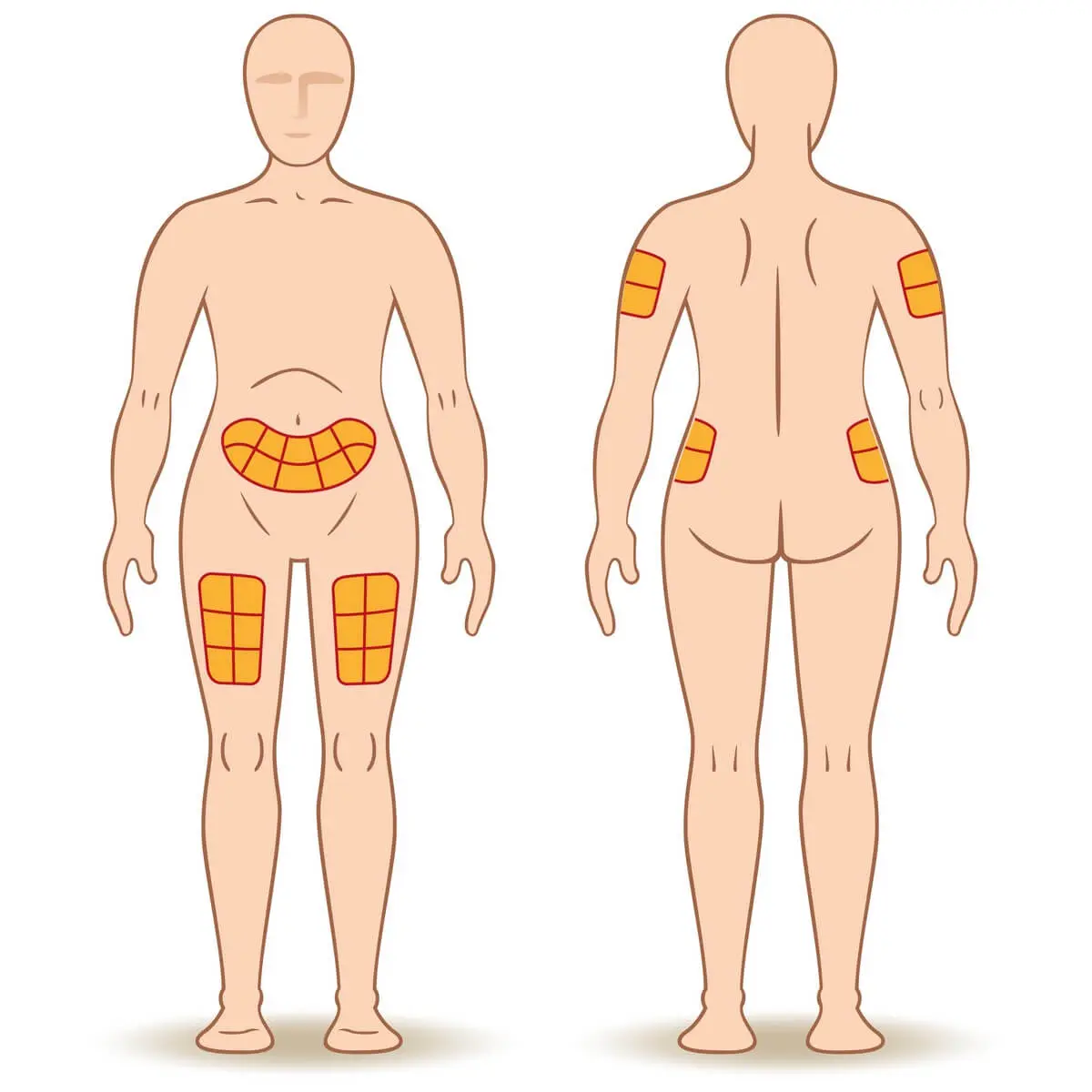
L’injection se fait au niveau du ventre, des bras ou des cuisses. La libération de l’insuline sera plus ou moins rapide selon le site. Une mauvaise pratique d’injection peut être à l’origine d’une lipodystrophie qui disparaitra d’elle-même (entre 3 à 6 mois) en arrêtant d’utiliser ce site.
Le diabète étant une maladie chronique les patients autonomes gèrent au quotidien leur glycémie, en adaptant les doses d’insuline selon leur objectif glycémique personnel.
Et la qualité de vie ?
La glycémie capillaire et l’injection d’insuline permet d’équilibrer le diabète et ainsi prévenir les complications. Mais qu’en est-il de la qualité de vie des patients ?
La 1ère pompe à insuline qui délivre un débit de base constant apparait en 1980 en Allemagne. Les années suivantes, cette technologie évolue. Cependant en 1994, seulement 1% des diabétiques sont porteurs d’une pompe. C’est en 2000, avec la prise en charge par l’assurance maladie que ce dispositif se développe. Il permet la délivrance de doses ajustables grâce à un cathéter introduit en sous cutané.
Le 1er capteur de glucose est commercialisé en 2001 mais il faudra attendre 2005 pour que le patient puisse lire le résultat en temps réel. Implanté sous la peau, il permet un dosage continu du glucose tout en évitant au patient de se piquer le doigt.
Il y a 10ans, un pancréas artificiel a été mis en place chez un patient du CHU de Montpellier dans le service du Pr Eric Renard. Il associe la pompe à insuline, le capteur de glucose mais également un programme informatique qui automatise le système. Ce « système de délivrance d’insuline en boucle semi-fermée » est en fait hybride, c’est-à-dire semi automatique. En effet, le pancréas artificiel demande une participation du patient.
En Février 2020, la HAS (Haute Autorité de Santé) recommande le remboursement du pancréas artificiel DBLG1 produit par une société Française (Diabeloop).
C’est l’évolution des technologies et leur prise en charge par l’assurance maladie qui a permis et qui permettra l’amélioration de la qualité de vie des personnes diabétiques.


